兰伯特-伊顿肌无力综合征(LEMS)是一种罕见的自身免疫性疾病,在美国大约每10万人中就有1人患病。主要症状是肌肉无力,这是电压门控钙通道自身抗体的结果,导致从神经末节释放的乙酰胆碱(ACh)数量减少。1
LEMS最常见的临床表现是近端肌无力和易疲劳,可能导致行走和爬楼梯困难。经典的LEMS三联征包括近端腿无力、反射不足或反射,胆碱能性自主神经功能障碍(口干、阳痿等)眼球无力少见。当虚弱涉及到呼吸肌时,症状可能危及生命。大约50%-60%的LEMS患者有潜在的恶性肿瘤,典型的是小细胞肺癌(SCLC)。2-4
Amifampridine在氨基酸
Catalyst已完成FDA临床开发并获得FDA批准amifampridine.,神经元钾通道阻滞剂,用于治疗lems。
Amifampridine以前接受过FDA的孤儿药物指定和突破治疗指定。2018年,催化剂将NDA归因于LEMS中的Amifampridine使用。截至2018年11月,Amifampridine是唯一的基于FDA的FDA批准的成人患者患者患有兰伯特 - 伊顿肌腱综合症(LEMS)的诊断治疗。
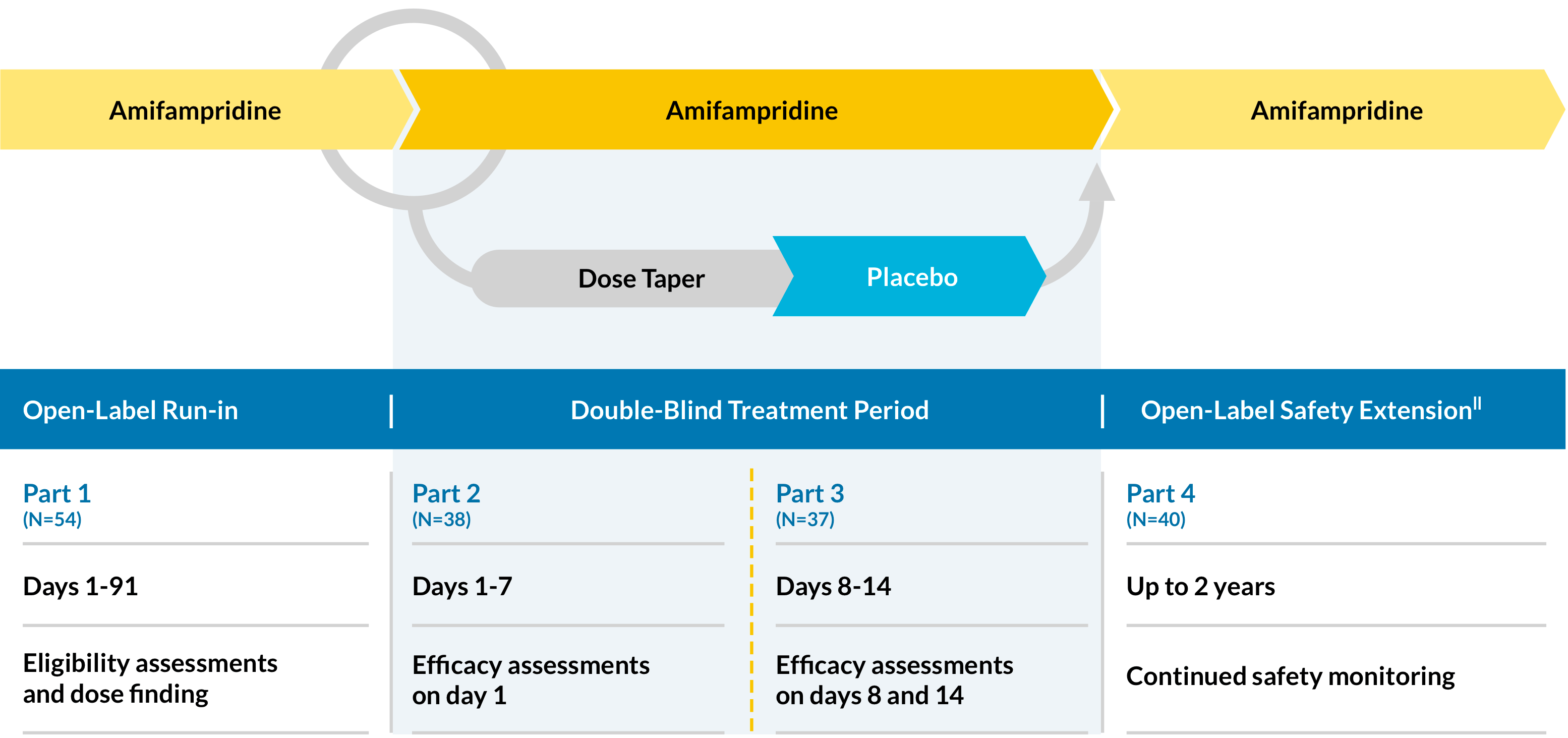
首个LEMS第三期试验(LMS-002)
LMS-002是一项3期、多中心、双盲、安慰剂对照、随机(1:1)、停药研究,分为4个部分来评估多剂量给药的有效性和安全性amifampridine.在LEMS患者中。
有效性的措施
主:
- QMG评分*从基线(第0天)到第14天的变化
- SGI评分的变化†基线(第0天)至第14天
。
二级:
- T25FW评分的变化‡基线(第0天)至第14天
- cgi分数的变化§基线(第0天)至第14天
安全评估
持续评估患者的安全性,并在2年开放标签延长期间进行剂量调整||
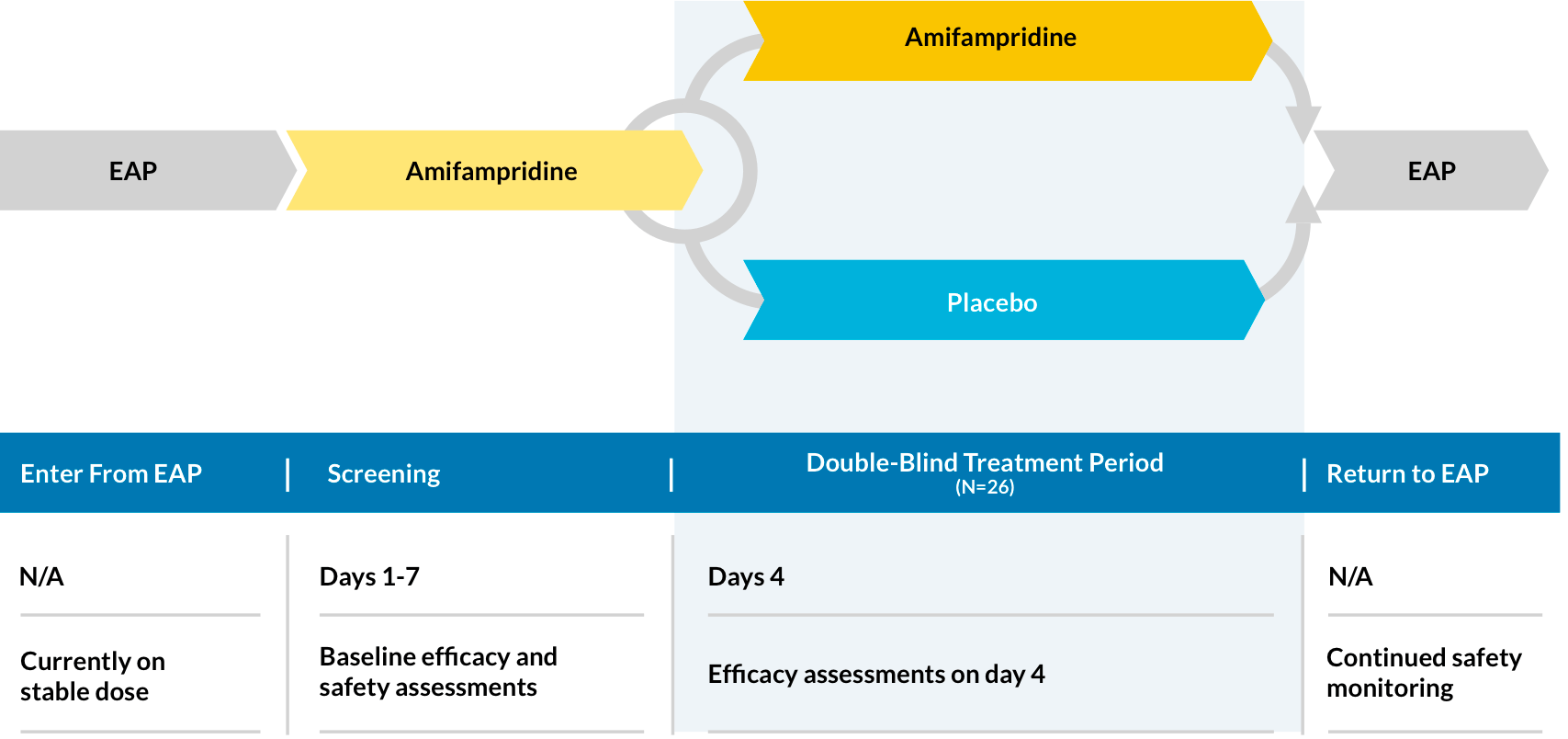
第二次LEMS第3阶段试验(LMS-003)
LMS-003是阶段3,双盲,安慰剂控制,随机(1:1),并行组研究,以评估疗效,安全性和效果磷酸氨氨酰胺LEMS患者的治疗。
有效性的措施
主:
- 从基线(第0天)到第4天结束的QMG得分*
- SGI评分的变化†从基线(第0天)到第4天结束
。
二级:
- cgi分数的变化§从基线(第0天)到第4天结束
探索性:
- 在基线(第0天)时,三重时间上的变化(3tug)得分于第4天完成测试
安全评估
患者安全在筛选期和整个EAP中进行评估
CGI-I =临床全球印象 - 全球改进;EAP =扩展的访问程序;NDA =新药申请;qmg =定量myasthenia gravis;SGI =主题全球印象;t25fw =时间25英尺走。
- QMG是使用13评估的医生额定试验,包括面部强度,吞咽,握力,肢体可以保持在伸出的位置。13项中的每一个都被评分为0(无)至3(严重)。总分可以从0到39. QMG总分比与LEMS的恶化症状相关。
- SGI是一个受试者对整体福祉变化的感知的变化的衡量标准。要求患者使用7分尺度来评估其在前面的3天内的研究药物的影响的印象,在他们的身体健康上。7点SGI标准:1 =可怕;2 =大多不满意;3 =混合;4 =部分满意;5 =大多满足;6 =很高兴;7 =很高兴。
- T25FW试验是多发性硬化功能性复合材料的组分,是基于定时25英尺的步行(国家多发生硬化学会)的定量移动和腿功能性能测试。患者旨在尽可能快速,安全地在明显标记的25英尺的过程中行走。剩下的至少5分钟后,重复了25英尺的步行。患者可以使用辅助装置,例如罐头,拐杖或步行者。(所有数据都被标准化为每分钟的脚数,因此如果患者在不到一分钟的时间内走25英尺,则结果速度大于25英尺/分钟。T25FW测试的测量是平均速度,表达2个完成的散步的英尺/分钟。)
- 研究人员完成了基于症状、行为和功能能力变化的7点CGI-I测试,在协议指定的时间点与第0天患者的情况相比较。7分CGI-I量表:1=非常改善;2 =大大提高;3 =最低限度提高;4 =没有变化;5 =差最小;6 =更糟;7 =非常糟糕。
- 在2年后续阶段(N-40)中,所有随机受试者和来自第1部分(第1-91天)的2个受试者继续进行。
引用:
- (1)吴建平,张建平,张建平,等;LEMS研究组磷酸氨苄啶(Firdapse®)在LEMS的3期临床试验中是有效和安全的。肌鼻子。2016; 53(5):717-725。
- orphanet。Lambert-eaton Myasthenic综合症。http://www.orpha.net/consor/cgi-bin/Disease_Search.php?lng=EN&data_id=10583&Disease_Disease_Search_diseaseGroup=Lambert-Eaton-myasthenic-syndrome&Disease_Disease_Search_diseaseType=Pat&Disease (s) / % 20国集团% 20疾病= Lambert-Eaton-myasthenic-syndrome&title = Lambert-Eaton-myasthenic-syndrome&search = Disease_Search_Simple。访问日期:2017年12月13日。
- Titulaer MJ, Lang B, Verschuuren JJ。兰伯特-伊顿肌无力综合征:从临床特征到治疗策略。柳狸神经酚。2011; 10(12):1098-1107
- 危害L,Sieb JP,Williams AE等。长期疾病史,临床症状,健康状况和医疗利用患者患有兰伯特伊顿骨髓综合征:德国患者面试调查结果。J地中海经济。2012; 15(3):521-530。
Musk-Mg临床
SMA临床

现在有一个FDA批准的成人批准的一线治疗,具有lems的成年人。1,2
- 癫痫发作的历史
- 对氨基氨酰胺磷酸盐或另一种氨基吡啶的过敏率